رابطه عجیب پروتئین و پیر شدن سلولها
پریسا عباسی: در تصاویر گرفته شده از نورون های مغزی بیماران آلزایمر، تجمع غیرطبیعی پروتئین تاو به صورت سیم پیچ های فیبری در نزدیکی هسته سلول ظاهر می شود. اگرچه این تجمع نشانه بیماری است، اما به نظر می رسد با افزایش سن، تجمع پروتئین در سراسر بدن اتفاق می افتد.
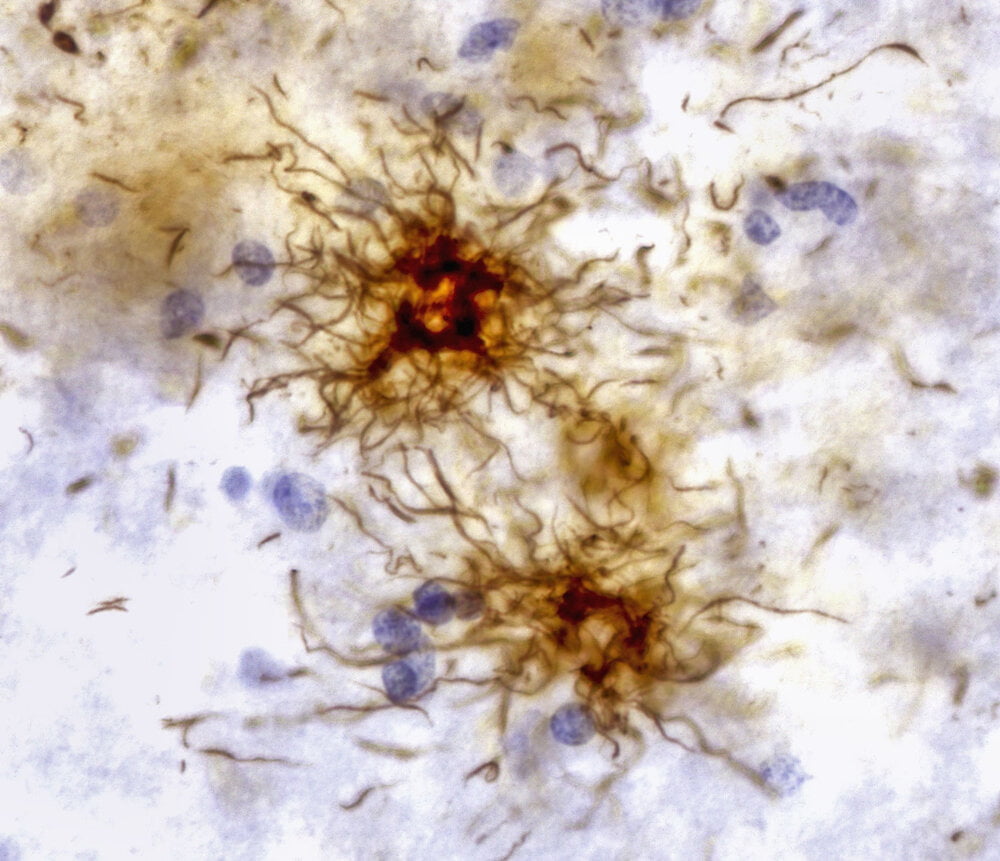
مغز افراد مسن مبتلا به آلزایمر، بیماری پارکینسون و سایر بیماریهای تخریبکننده عصبی مملو از تودههای پروتئینی خاص در داخل یا اطراف نورونها است. هنوز مشخص نیست که چگونه این تجمعات پروتئینی می توانند به نورون ها آسیب برسانند، اما وجود این تجمعات پروتئینی نشانه واضحی از این شرایط است.

یک مطالعه اخیر توسط یک تیم تحقیقاتی دانشگاه استنفورد نشان می دهد که تجمع پروتئین ممکن است یک پدیده رایج در سلول های پیری باشد و ممکن است نقش مهمی در بسیاری از بیماری های پیری نسبت به آنچه قبلا تصور می شد ایفا کند. این کشف راه جدیدی را برای تفکر در مورد مشکلاتی که با افزایش سن در سلول های ما ایجاد می شود، باز می کند.
این مطالعه همچنین نشان میدهد که تجمع پروتئین ارتباط نزدیکی با مکانیسمهای اساسی دارد که به سلولها اجازه میدهد فیزیولوژی خود را تنظیم کنند. زیست شناسان باید به دقت این موضوع را مورد به مورد ارزیابی کنند تا بفهمند که آیا توده های پروتئینی تهدیدی برای سلول ها هستند یا از آنها محافظت می کنند.
در این مطالعه گونه های ماهی با طول عمر بسیار کوتاه مورد بررسی قرار گرفت. این مطالعه نشان داد که تجمع پروتئین در طول زمان احتمالاً باعث زوال تدریجی بسیاری از بافتها میشود. یافتهها همچنین به این نکته اشاره میکنند که چرا این تجمع در مغز بیشتر از سایر بافتهای بدن است. شاید به این دلیل است که مغز خیلی سریع تکامل یافته است.
سرنخ ماهی
ماهی فیروزه ای آفریقایی در دریاچه های فصلی در شرق آفریقا زندگی می کند که در فصل بارندگی شکل می گیرد. از آنجایی که این ماهی ها به پایان عمر کوتاه خود یعنی چهار تا شش ماه می رسند، از بیماری های مرتبط با افزایش سن رنج می برند، از جمله آب مروارید و تغییرات مغزی مشابه اختلالات عصبی مانند آلزایمر در انسان. طول عمر کوتاه ماهیها بسیار کوتاهتر از موشهای آزمایشگاهی است و روند طبیعی پیری آنها سریع است، که آنها را به مدلی ایدهآل برای مطالعه پیری در مهرهداران تبدیل میکند.
داریو والنزانو، زیستشناس تکاملی گفت: «چیزی که در مورد این ماهیها شگفتانگیز است این است که این ماهیها تجمع پروتئین یا نارسایی قلبی یا اختلال عملکرد مغز با افزایش سن نیست.» در عوض، تقریباً هر اندام و بافتی که میبینیم در طول فرآیند پیری دچار تغییرات فاجعهبار میشود.»
تیم استنفورد تجزیه و تحلیل های گسترده ای از پروتئین مداکا در مراحل مختلف، از نوجوانی تا بزرگسالی انجام داد. با نگاهی به تمام بافت های پیر در ماهی های پیر، متوجه شدیم که تجمع پروتئین وجود دارد. این اندام ها نه تنها مغز، بلکه قلب، روده، کبد، ماهیچه ها، پوست و بیضه ها را نیز شامل می شود. در آزمایشهای بعدی، بیش از نیمی از پروتئینهای انباشته شده تمایل به تراکم ذاتی را نشان دادند.
با این حال، دقیقاً اینکه کدام پروتئین ها انباشته می شوند از بافتی به بافت دیگر متفاوت است. بسیاری از پروتئینها اساساً در سطوح یکسان در بافتهای مختلف وجود داشتند، و در حالی که در یک بافت انباشته میشدند، در بافتهای دیگر اصلاً تجمع پیدا نکردند.

اهمیت کنترل کیفیت
شواهد خوبی از کرمها و مگسها وجود دارد که نشان میدهد وقتی سیستمهایی که پروتئینها را ثابت نگه میدارند مختل میشوند، حیوانات سریعتر پیر میشوند. اگر مسیرهای کنترل کیفیت پروتئین از نظر ژنتیکی افزایش یابد، حیوانات عمر طولانی تری خواهند داشت. هیچ یک از اینها نشان نمی دهد که تراکم پروتئین باعث پیری می شود، اما نشان می دهد که این دو ارتباط نزدیک دارند.
برای بررسی بیشتر رابطه بین تراکم پروتئین و پیری، محققان استنفورد نگاهی دقیقتر به پروتئینهای گونههای ماهی قاتل که بهطور غیرمعمولی به سرعت پیر میشوند را مورد بررسی قرار دادند. این ماهی دارای جهش در ژن آنزیم تلومراز است که طول کروموزوم های تقسیم شده را حفظ می کند. حیوانات دارای جهش تلومراز معمولاً به سرعت پیر می شوند.
جاروس گفت که او و همکارانش انتظار داشتند تراکم کمتری در روده و سایر سازمانهایی که به سرعت در حال رشد هستند جایگزین شوند. با این حال برعکس این اتفاق افتاد. بافت های با رشد سریع تراکم پروتئین بالاتری داشتند و سریعتر از بافت هایی با رشد آهسته پیر می شوند.
بنابراین، دوباره، مسائل مربوط به کنترل سلولی بر کیفیت پروتئین ممکن است دلیل این مشکل باشد. هنگامی که سلول ها کنترل خود را بر فرآیند حفظ کیفیت پروتئین از دست می دهند، آسیب بیشتری از تراکم با هر تقسیم سلولی رخ می دهد. بافت هایی که سریع رشد می کنند سریعتر پیر می شوند زیرا احتمال تجمع آسیب بیشتر است.
دلایلی که گاهی اوقات پروتئین ها تجمع می یابند پیچیده است. با کمال تعجب، بخشی از پاسخ به این سوال اساساً به مکانیسم اساسی که سلول ها برای کنترل پروتئین ها استفاده می کنند مرتبط است: تراکم.
بیشتر بخوانید:
اینکه دقیقاً چه چیزی پروتئینها را جذب میکند و تودهها را تشکیل میدهد، و اینکه این دانهها چقدر برای سلولها مشکلساز هستند، هنوز یک بحث بزرگ و ویژه در این زمینه است. نمونه بارز اثر محافظتی به دست آمده از این مطالعات، پروتئین آنتی گانتین است که برای رشد سالم سیستم عصبی ضروری است، اما در افراد مبتلا به بیماری هانتینگتون، جهش باعث طولانی شدن غیر طبیعی پروتئین آنتی گانتین می شود. سپس این پروتئین طولانی به قسمت های کوچک و سمی شکسته می شود که به سیستم عصبی آسیب می رساند.
در سال 2004، استیو فینکبینر، محقق سالخورده در مؤسسه گلادستون و دانشگاه کالیفرنیا، سانفرانسیسکو، تجمع پروتئین هانتینگتین را در سلول های عصبی کشت شده مورد مطالعه قرار داد. در این مطالعه، تیم او نشان داد که نورونهای دارای پروتئین غیرطبیعی هانتینگتین همگی در طول زمان میمیرند، اما نورونهایی با تجمع هانتینگتین میتوانند بیشتر از نورونهای بدون پروتئین زنده بمانند.
از آن زمان، او و دیگران نشان داده اند که پاسخ های تجمعی حمایتی در سایر بیماری های عصبی نیز رخ می دهد. این می تواند شکست های پی در پی آزمایش های آلزایمر را برای هدف قرار دادن پلاک ها توضیح دهد. وی در این باره چنین می گوید. اگر پلاکهای آمیلوئیدی که باعث این بیماری میشوند مانند پروتئینهای محافظ به یکدیگر متصل شوند، تخریب این پلاکها ممکن است بیشتر از اینکه فایده داشته باشد، ضرر داشته باشد.
فینکبینر نوشت: اما زیست شناسی یک علم پیچیده و پر از شگفتی است. بنابراین بسیار مهم است که مردم فریب نتیجهگیریها را نخورند.»
یک چالش مشترک با راه حل های بسیار
نتیجه واضحی که اکنون به آن رسیده ایم این است که تجمع پروتئین پدیده ای محدود به بیماری های عصبی نیست. تجمع پروتئین بخشی از هر سلولی است که به اندازه کافی عمر می کند تا پیر شود. بسیاری از پروتئین های طبیعی و مهم، مانند DDX5، مستعد تجمع هستند و مدیریت این تجمع یک چالش فراگیر برای همه سلول ها است.
سلولها مدتهاست که با این مشکل دست و پنجه نرم میکنند، بنابراین جلوگیری از تجمع سلولی ممکن است یک وظیفه مهم در تکامل توالیهای پروتئین باشد. از آنجایی که بسیاری از پروتئین ها تمایل به تجمع دارند و جهش ها این تمایل را افزایش می دهند، به احتمال زیاد بسیاری از پروتئین ها به طور طبیعی در برابر جهش ها مقاوم هستند. (این نتیجه گیری نتیجه این واقعیت است که بیشتر پروتئین ها در حیوانات جوان تمایل جهشی کمی دارند). بنابراین، پروتئینهای کمتر میتوانند سریعتر از پروتئینهای فراوانتر تکامل پیدا کنند و سرعت تکامل باید با تمایل تجمع مطابقت داشته باشد.
این تأثیر در مغز ماهی قاتل بسیار مشهود بود. محققان گمان می کنند که این پروتئین ها ممکن است کلیدی برای نوآوری طولانی مدت بوده باشند. اگر چنین است، تغییرات تکاملی در مغز که آن را به عضوی مهم برای مهرهداران تبدیل کرده است، ممکن است آن را مستعد بیماریهای دژنراتیو ناشی از انباشتگی کند.
در واقع، هر بافت و اندامی برای عملکرد صحیح و مدیریت تجمع پروتئین باید به تعادل متفاوتی برسند. هر سازمانی دارای الزامات و محدودیت های ویژگی منحصر به فرد است. سلول های روده دائما در حال تغییر هستند. سلول های غدد درون ریز هورمون ترشح می کنند. سلول های مسئول ایمنی بدن با شناسایی مهاجم فعال می شوند. مغز اطلاعات را پردازش می کند. وظایف مختلف به پروتئین های متفاوتی نیاز دارند، به این معنی که استراتژی های تکامل یافته برای مقابله با تجمع پروتئین از بافتی به بافت دیگر و از حیوانی به حیوان دیگر متفاوت است. اخیراً، مغز مهرهداران بسیار سریعتر و گستردهتر از مثلاً ماهیچهها تکامل یافتهاند، بنابراین دستگاههای کنترل کیفیت پروتئین ممکن است زمان کافی برای تکامل سیستمهای حفاظتی مناسب برای مجموعههای پروتئینی نسبتاً جدید نداشته باشند. .
با این حال، مشکل اساسی تجمع پروتئین در همه موجودات وجود دارد و این مشکل به بیمار بودن یا تحت استرس شدید محدود نمی شود. ، موش ها و انسان ها
5858